|
糖尿病(DM)的发病率在全球范围内呈上升趋势,糖尿病肾病(DKD)作为糖尿病的常见并发症之一,在T2DM人群中的患病率约为20%~40%,并且超过40%的终末期肾病患者是由DKD引发的。 目前尚无特定的DKD药物,主要以对症治疗为主,包括降糖、降脂、降压和抗炎治疗等。中医(TCM)的辨证论治的个体化方法在临床治疗DKD中得到了广泛应用,并取得了良好的疗效。然而,中医药防治DKD的作用机理及应用仍需深入研究。 肾康注射液(SKI)主要由大黄、红花、黄芪、丹参四种药用植物提取的有效成分组成,具有降逆泄浊、益气活血、通腑利湿的作用。SKI可改善CKD及其并发症,如慢性肾炎、肾功能不全、肾小球肾炎、慢性肾功能衰竭等。中国食品药品监督管理局于2004年批准SKI为慢性肾功能衰竭的静脉注射中成药(Z20040110)。 日前,一篇名为“Network pharmacology-based study on the mechanism of ShenKang injection in diabetic kidney disease through Keap1/Nrf2/Ho-1 signaling pathway”的研究引起了我们的关注,研究团队通过网络药理学以及体内外实验,研究SKI对DKD大鼠肾脏的影响及其对由Keap1/Nrf2/Ho-1信号通路介导的氧化应激的作用。
 论文首页
论文首页SKI-DKD网络的药理学分析 基于TCMSP和数据库,研究者成功鉴定了280个SKI靶点。从五个疾病数据库中获得了1197个与DKD相关的疾病靶点,最终筛选出118个重叠靶点。通过蛋白相互作用分析发现核心靶点主要包括NOS3、PTGS 2、CASP 3、CCL 2、CXCL 8、HIF 1A、AKT 1等。在“药物-成分-疾病-靶点”网络中,槲皮素、山奈酚和木犀草素的自由度最高,提示它们可能是SKI治疗DKD的核心活性成分。 通过GO分析预测,研究者发现主要生物过程包括激素反应、脂多糖反应、氧水平反应和炎症反应等,主要分子功能包括转录因子结合、核受体活性和磷酸酶结合等。KEGG预测显示,SKI预防和治疗DKD的机制可能与AGE-RAGE信号通路、流体剪切应力和动脉粥样硬化等通路有关。结合文献分析,研究者推测SKI可能是通过影响氧化应激相关的信号通路,调节AGEs诱导的氧化应激,预防DKD肾损伤。为了进一步验证这一推测,研究者针对经典的keap 1/Nrf 2/Ho-1信号通路进行体外和体内实验研究。
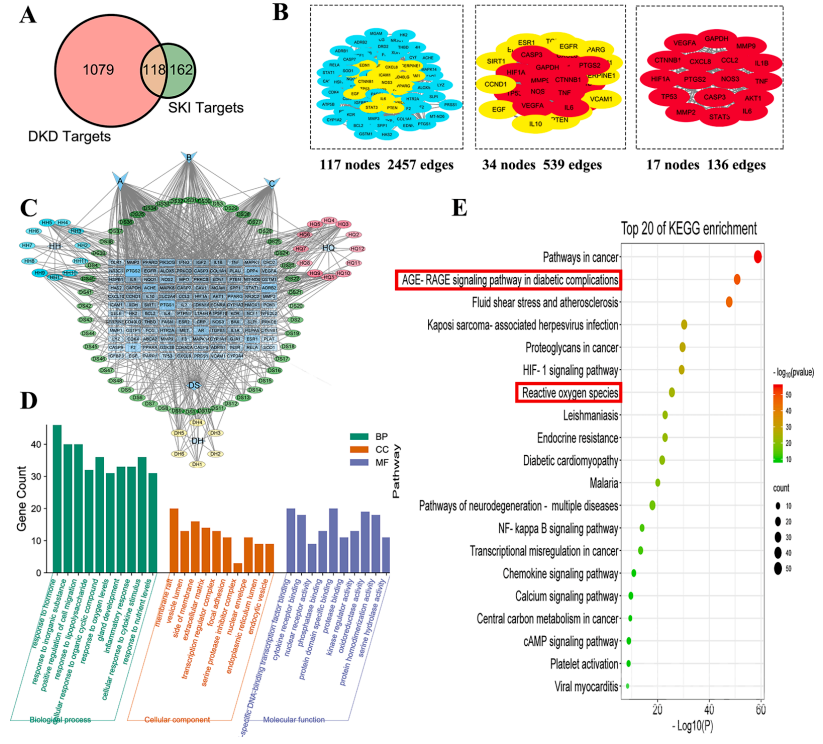
图2 SKI-DKD网络的药理学分析 SKI对DKD大鼠体重、24小时尿蛋白、肾功能和血脂的影响 在高糖高脂饮食+腹腔注射链脲佐菌素后,DKD大鼠出现不适、活动减少、饮水量明显高于对照组,24 h尿量明显增加。造模后12 周,模型组出现泌尿系统感染、足趾溃疡、下肢水肿等糖尿病并发症。与模型组相比,厄贝沙坦(IRB)组和SKI组大鼠的一般生理状况较好。每4周对大鼠称重,结果显示随着实验的进行,与对照组中的大鼠相比,其余三组体重逐渐降低。与模型组相比,虽然治疗组的体重最初也缓慢下降,但从给药后的8周开始逐渐恢复(图3 A)。 与对照组比较,DKD模型组大鼠24 h尿蛋白水平、血清Scr和Urea含量较对照组逐渐升高,而两个给药组24 h尿蛋白升高率均较低。与模型组相比,IRB组和SKI组的24小时尿蛋白水平显著降低,SKI组和IRB组的组间差异不显著。(图3B-D)模型组大鼠血清TC、TG、LDL水平显著升高。与模型组相比,SKI组的TC、TG和LDL显著降低;IRB组的TC显著降低,但TG和LDL无显著差异(图3 E-G)。
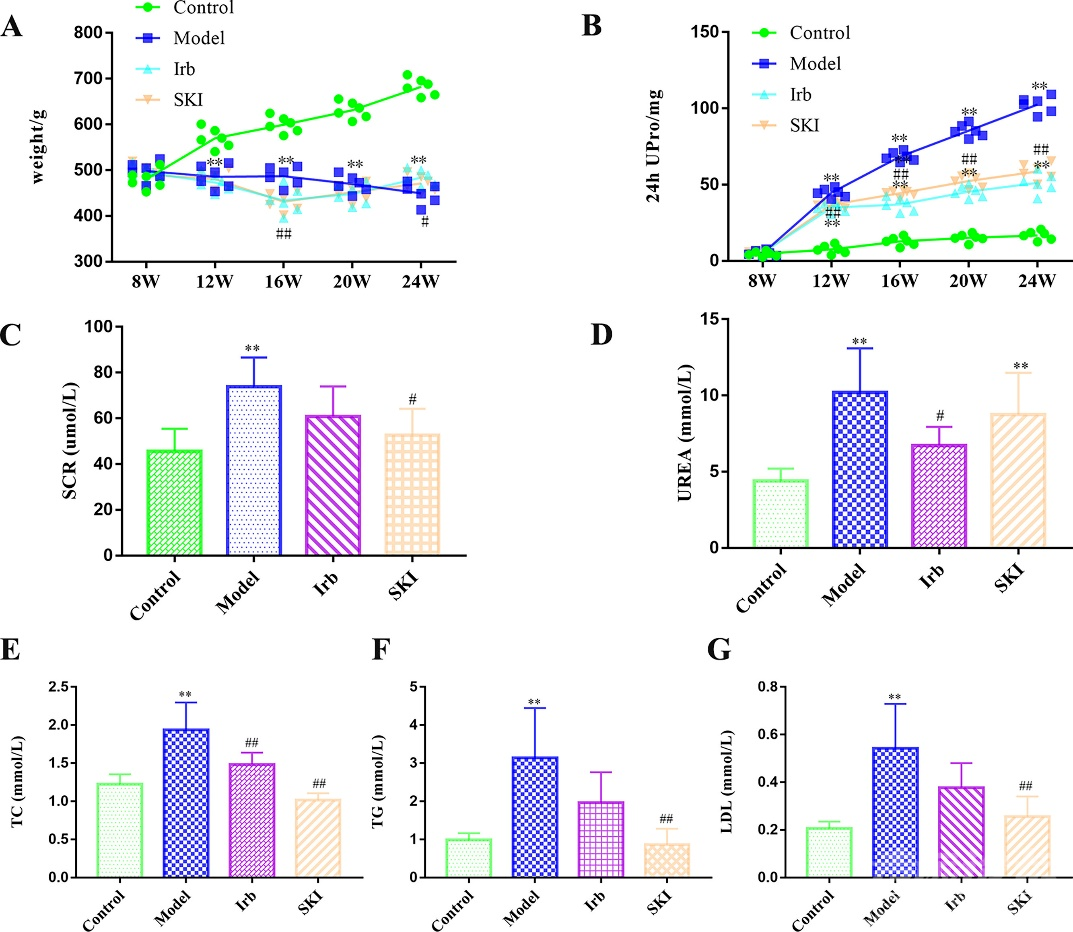
图3 SKI对DKD大鼠体重、24小时尿蛋白、肾功能和血脂的影响 SKI对DKD大鼠血清氧化应激及肾组织脂质过氧化的影响 与对照组比较,模型组大鼠血清ROS水平较高,而SOD和NO水平显著低于对照组。与模型组相比,SKI组大鼠血清中ROS水平显著降低,而NO表达增加,SOD有升高趋势(图4 A-C)。与对照组相比,DKD模型组大鼠肾脏组织中LOP、MDA和Fe 2+水平显著增加,与DKD模型组相比,IRB组和SKI组大鼠肾脏组织中LOP、MDA和Fe 2+水平显著降低(图4 D-F)。
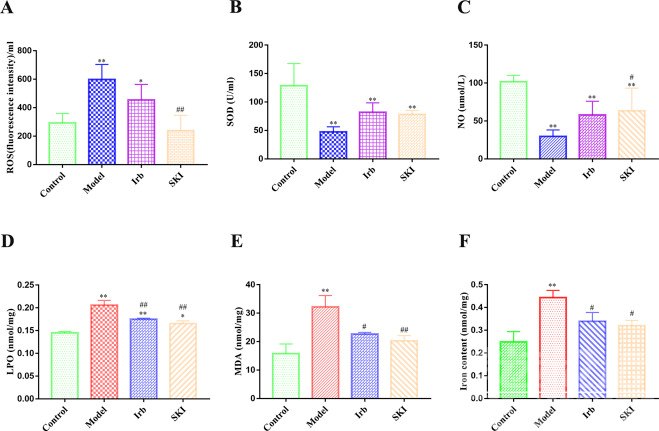 图4 SKI对DKD大鼠血清氧化应激及肾组织脂质过氧化的影响
图4 SKI对DKD大鼠血清氧化应激及肾组织脂质过氧化的影响SKI可减轻DKD大鼠肾脏组织病理损伤 通过HE染色观察,对照组大鼠的肾小球、肾小管结构正常。DKD模型组大鼠的肾组织出现肾小球肥大、系膜细胞和基质增生、肾小管上皮细胞空泡变化、蛋白管型栓塞及肾间质炎性细胞浸润等病理改变。IRB组和SKI组的病理情况有所改善。进一步利用Mallory染色观察,对照组大鼠的肾小球及肾小管结构保持正常,而DKD模型组大鼠肾组织中出现了大量蓝色胶原纤维,表明部分区域肾小球硬化及肾小管间质纤维化。经IRB和SKI治疗后,与模型组相比,胶原纤维明显减少,肾小球硬化和肾小管间质纤维化的程度也相应减轻。透射电镜下观察,对照组大鼠足细胞的基底膜及足突正常。DKD大鼠肾小球超微结构发生了明显改变,足突间的交错排列消失,基底膜异常增厚。IRB组和SKI组大鼠肾小球病理改变均有不同程度的改善(图5)。
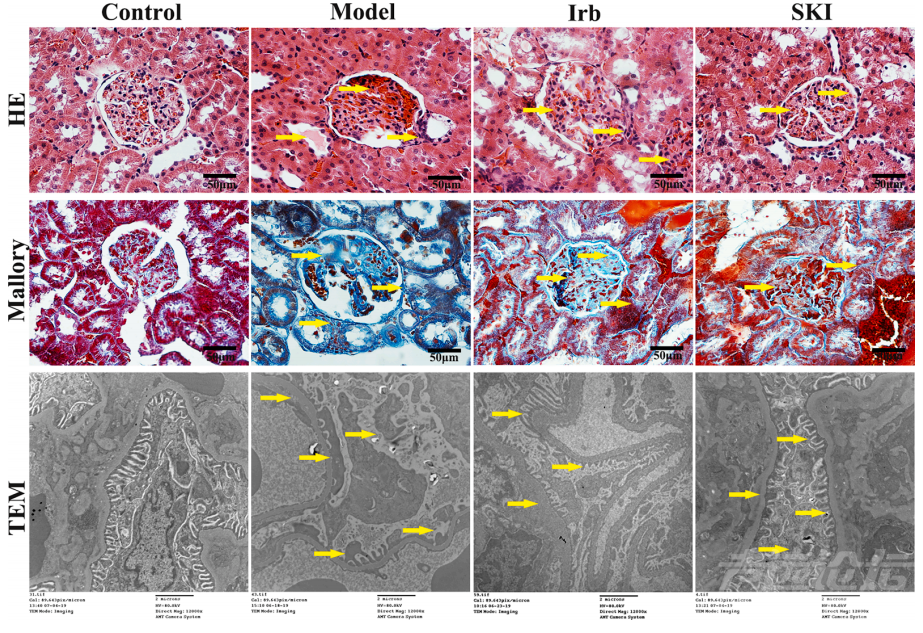
图5 SKI可减轻DKD大鼠肾脏组织病理损害 SKI对DKD大鼠肾组织Keap1、Nrf2、HO-1和Gpx4 mRNA表达水平的影响根据琼脂糖凝胶电泳结果显示,DKD模型组大鼠肾组织中的Keap 1表达显著增加,而在IRB组和SKI组中,Keap 1的表达明显减少。对照组中Nrf 2和Ho-1 mRNA表达水平较低,DKD大鼠的Nrf 2和Ho-1 mRNA表达呈现出轻微上升趋势,而SKI组Nrf 2和Ho-1的表达明显增加。DKD模型组中的Gpx 4 mRNA表达降低,但经过SKI干预后,Gpx 4 mRNA表达显著升高。相较于模型组,IRB组中的Nrf 2和Ho-1以及Gpx 4的mRNA表达并无显著差异(图6)。
 图6 SKI对DKD大鼠肾组织Keap1、Nrf2、HO-1和Gpx4 mRNA表达水平的影响
图6 SKI对DKD大鼠肾组织Keap1、Nrf2、HO-1和Gpx4 mRNA表达水平的影响SKI对肾组织中Keap1、Nrf2、Ho-1和Gpx4蛋白表达的影响 免疫组化结果显示,DKD模型组大鼠肾脏中Keap 1蛋白表达水平比Ho-1蛋白表达水平增加更明显,且增加幅度均超过对照组。相比之下,SKI组大鼠肾脏中的Ho-1蛋白表达水平显著高于模型组,而Keap 1蛋白表达水平则显著低于模型组。另外,DKD模型组大鼠肾脏中Nrf 2和Gpx 4蛋白的表达水平明显低于对照组,而SKI组大鼠肾脏中Nrf 2和Gpx 4蛋白表达水平则显著高于模型组。 这些数据表明,SKI对DKD模型大鼠肾脏的保护作用可能与上调Ho-1、Nrf 2和Gpx 4蛋白的表达以及下调Keap 1蛋白的表达有关(图7,A-E)。
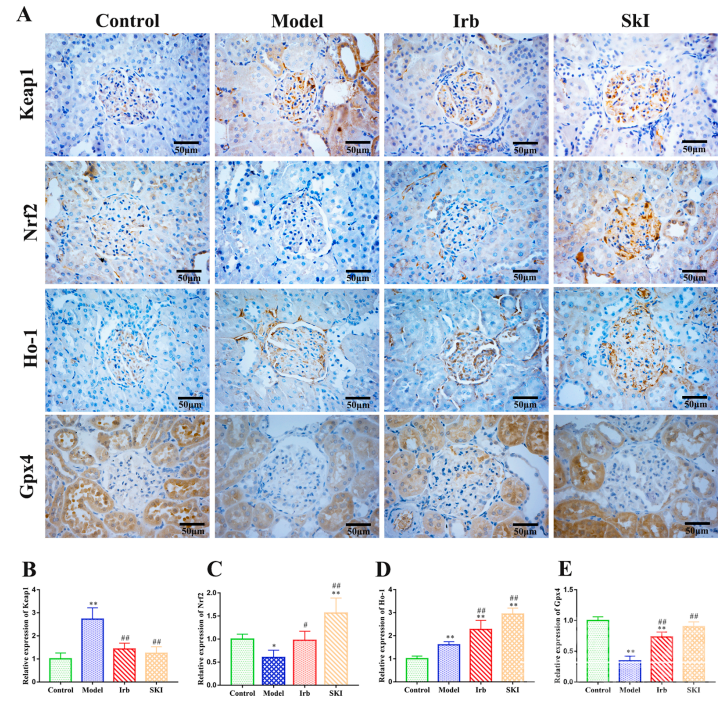
图7 SKI对DKD大鼠肾组织Keap1、Nrf2、HO-1和Gpx4蛋白表达的影响 SKI可显著增强HK-2细胞活力 研究者进行了CCK-8实验以确定最佳的SKI浓度。结果表明4%的SKI浓度最佳,可用于后续的细胞实验(图8A)。通过CCK-8检测,研究者发现200 μg/ ml 的AGEs刺激24小时和48小时后,HK-2细胞活力显著降低,与AGEs模型组相比,SKI可显著增强HK-2细胞活力(图8B)。 通过观察HK-2细胞的形态,发现对照组中的HK-2细胞是完整的,呈现出梭形,并且具有理想的粘附能力。与AGEs模型组相比,SKI能够诱导HK-2细胞形态的改善(图8C)。 此外,DCFH-DA荧光探针染色结果显示,对照组ROS含量处于较低水平,AGEs刺激后HK-2细胞内ROS含量显著升高,令人欣慰的是,SKI可显著降低AGEs诱导的ROS升高(图8D)。
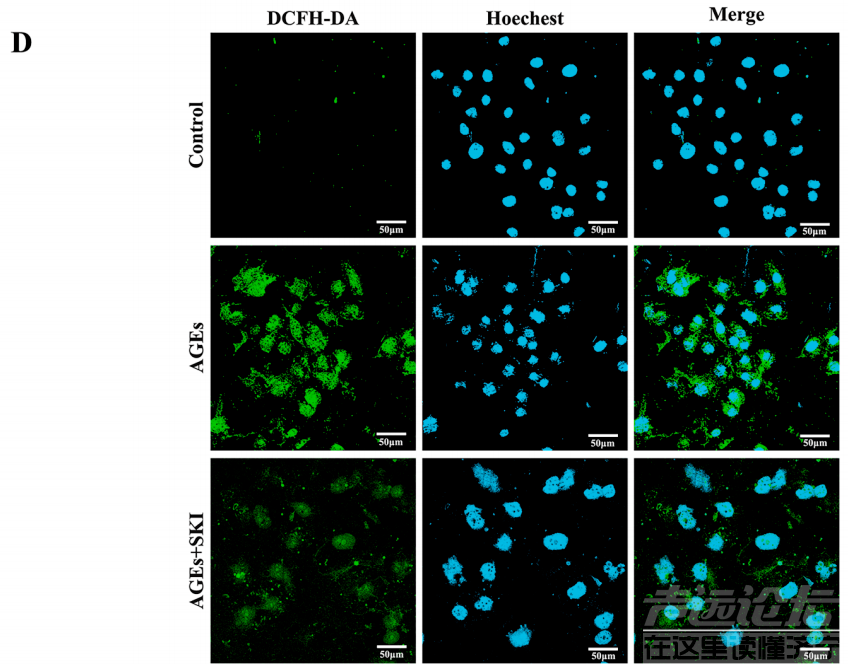
图8 SKI对AGEs损伤的HK-2细胞活性和ROS的影响 SKI对AGEs损伤的HK-2细胞keap 1/Nrf 2/Ho-1信号通路的影响 免疫荧光实验结果显示,对照组中的HK-2细胞中Gpx4蛋白显示出强烈的荧光信号,而经过AGEs刺激后,Gpx4的荧光信号明显减弱,而SKI的干预可显著增加Gpx4的荧光信号强度(图9A)。 另外,Western Blot分析发现,与对照组相比,AGEs组的Keap1蛋白表达显著增加,然而AGEs+SKI组的蛋白表达降低,AGEs组中的Ho-1蛋白表达增加,而AGEs+SKI组中的蛋白表达显著增加。 最后,与对照组相比,AGEs组中的Nrf2和Gpx4蛋白表达显著降低,而AGEs+SKI组中的Nrf2和Gpx4蛋白表达显著增加(图9B、C)。
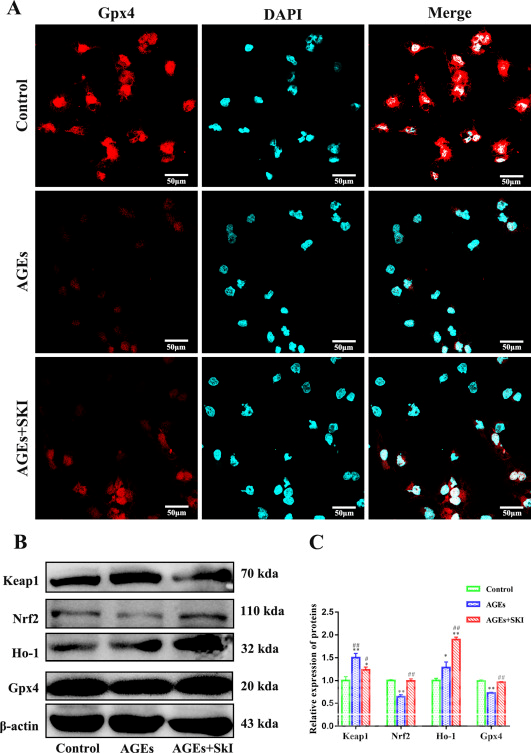
图9 SKI对AGEs损伤的HK-2细胞Keap1、Nrf2、HO-1和Gpx4蛋白的影响 结论综上所述,本研究发现,SKI可改善DKD大鼠的一般症状,显著减少24 h蛋白尿,有效保护肾功能,降低血脂,减少AGEs诱导的肾小管氧化应激损伤。SKI保护大鼠肾功能的分子机制可能与其调节Keap1/Nrf2/Ho-1信号通路有关,增加下游GPX4等抗氧化酶的含量,促进机体抗氧化系统的激活,实现肾功能的保护。
|